Was sind VanderWaalsKräfte? YouTube

van der waals kräfte definition beispiel mit video My XXX Hot Girl
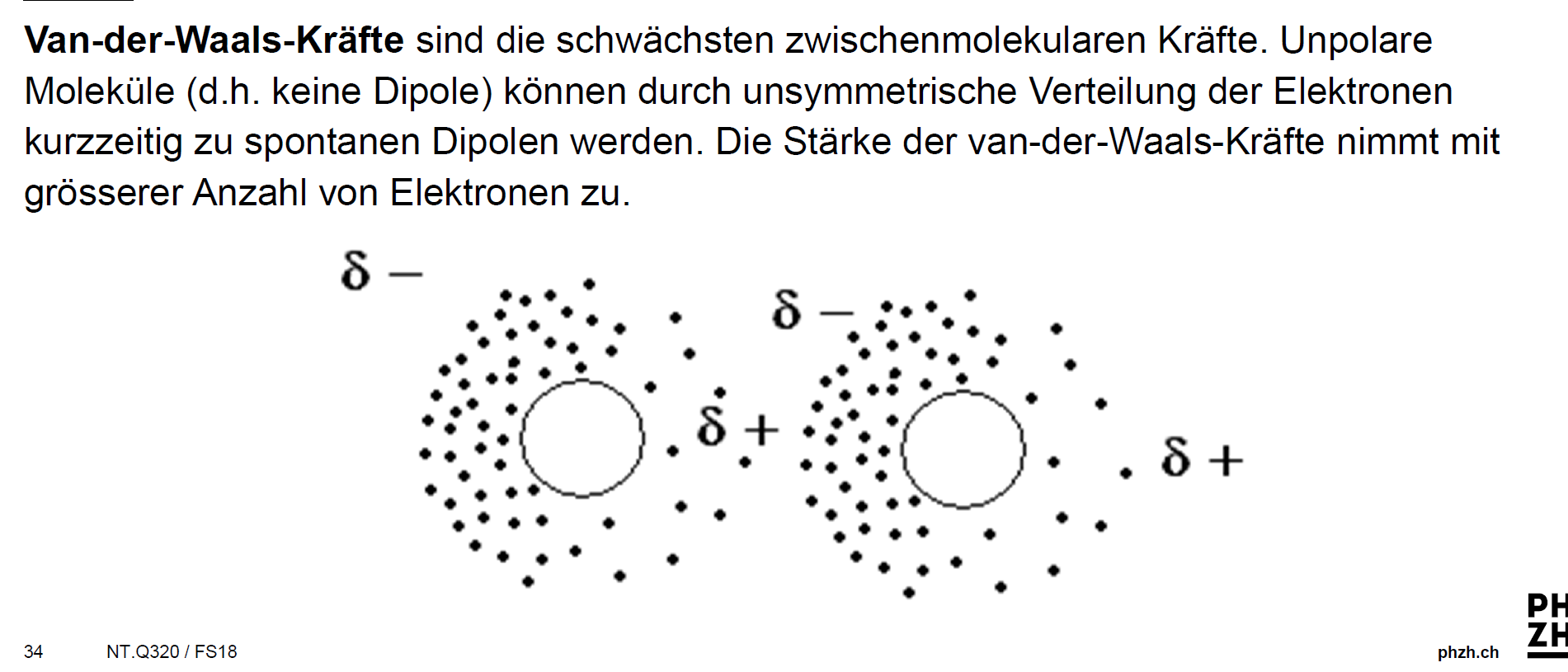
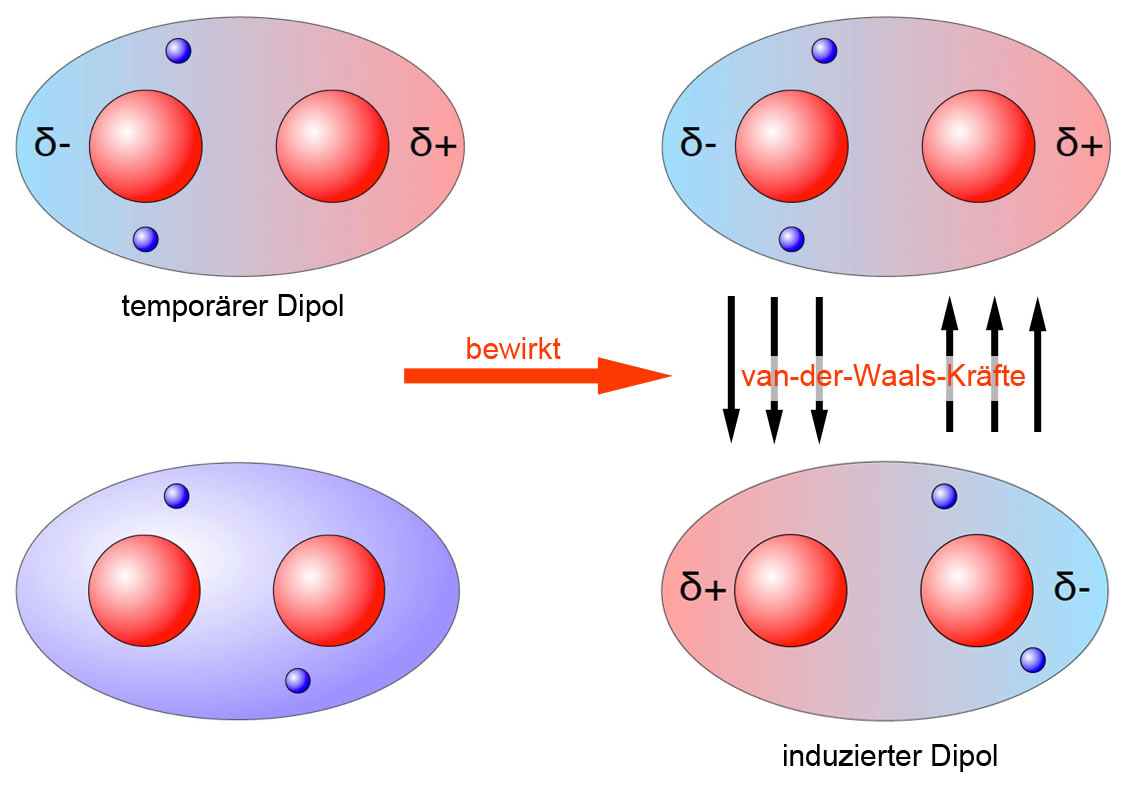
Aufgrund der kurzen Lebensdauer dieser Dipole bilden sich zwischen ihnen schwache Anziehungskräfte aus. Diese Kräfte heißen Van-der-Waals-Kräfte. Sie sind nach dem niederländischen Physiker Johannes D. van der Waals (1837-1923) benannt, der für die Entdeckung dieser Wechselwirkungen 1910 den Nobelpreis erhielt. Der Forscher erklärte.

VanderWaalsKräfte · Definition & Beispiel · [mit Video]
Alkane mit 5 - 20 Kohlenstoffatomen sind Flüssigkeiten, also ab Pentan. Alkane mit mehr als 20 Kohlenstoffatomen sind Feststoffe. Alkanmoleküle sind unpolar, es gibt also keinen Ladungsschwerpunkt im Molekül. Deshalb wirken zwischen den Molekülen auch nur schwache Kräfte, die Van-der-Waals-Kräfte . Daher sind die Siede- und.
Was sind VanderWaalsKräfte 01 Chemie Stoffeigenschaften und Teilchenmodell Repetico
Der Einfluss der Van-der-Waals-Kräfte lässt sich am Beispiel der Alkane verdeutlichen: Mit zunehmender Kettenlänge nimmt der Siedepunkt zu. So hat Ethan zum Beispiel einen Siedepunkt von -88,6 °C, während n-Heptan einen Siedepunkt von 98,4 °C hat.
Löslichkeiten von Fett (Van der Waals Kräfte?)? (Chemie, alkane, Löslichkeit)
Vergleichen wir einmal die Siedepunkte der ersten vier Alkane mit den Siedepunkt der von diesen Alkanen abgeleiteten Chlor-Alkane. n Alkan Chlor-Alkan; 1: Methan: -161.6: Chlor-methan: -23,8: 2: Ethan: -88,6:. In den meisten Schulbüchern werden diese sehr schwachen intermolekularen Wechselwirkungen als van-der-Waals-Kräfte bezeichnet.

Kohlenwasserstoffe • Aliphatische, Aromatisch, Halogeniert · [mit Video]
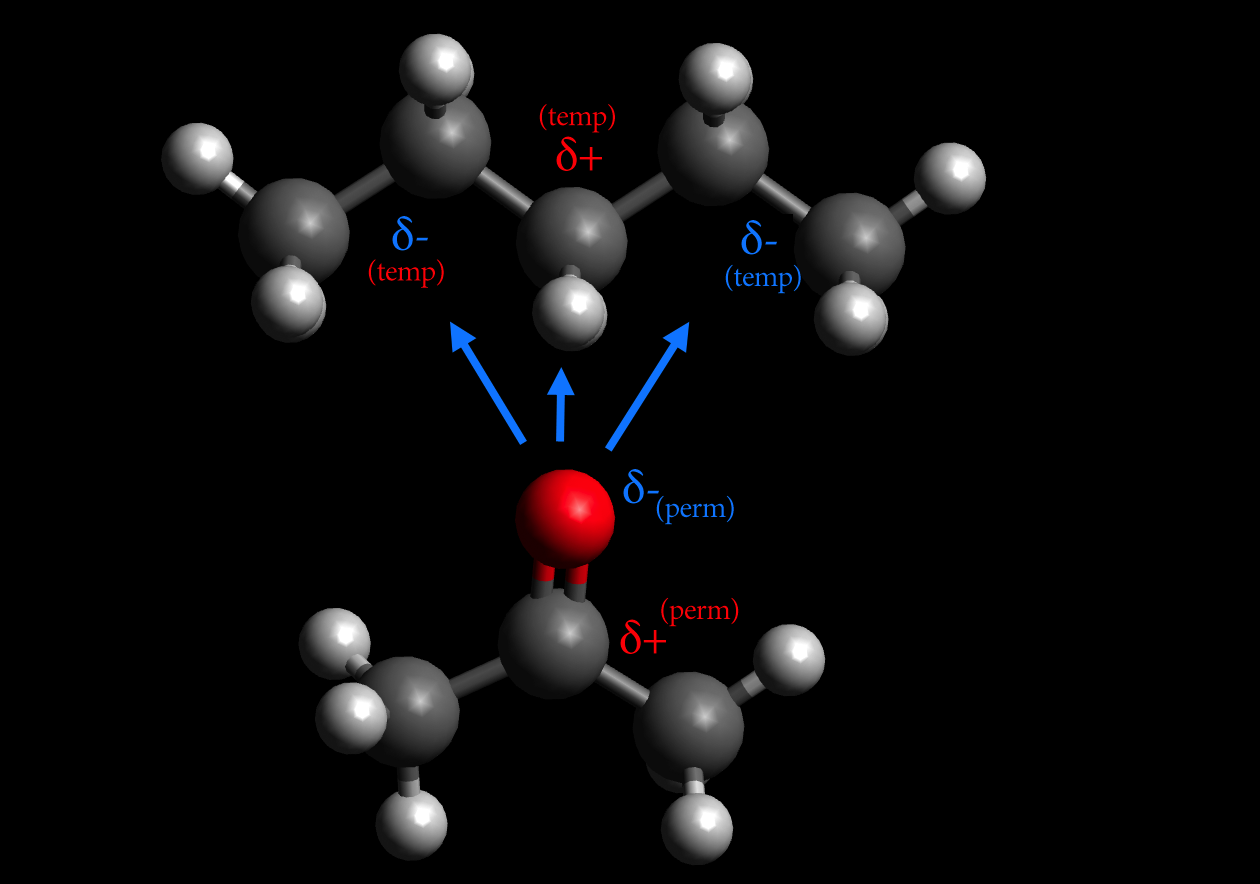
Physikalische Chemie. Mit den Van-der-Waals-Kräften ( Van-der-Waals-Wechselwirkungen ), benannt nach dem niederländischen Physiker Johannes Diderik van der Waals (1837-1923), [1] bezeichnet man die relativ schwachen nicht- kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungs energie mit etwa der sechsten Potenz.
vanderWaalsKräfte
Die Van-der-Waals-Kräfte werden stärker!. Alkanole, Alkohole, Alkane, Alkanale, Alkansäuren, homologe Reihe, Siedetemperaturen, Löslichkeit.. Der Schwerpunkt liegt auf der Anwendung erworbener Kenntnisse bzgl. der zwischenmolekularen Wechselwirkungen zur Erklärung von Siedetemperaturen (und ggf. auch Löslichkeit)..

VanderWaalsKräfte SchulLV
Die van-der-Waals-Kräfte nehmen mit zunehmender Kettenlänge, also zunehmender Masse der Moleküle und zunehmender Berührungsfläche, zu.Das hat zur Folge, dass sich die Moleküle mit zunehmender van-der-Waals-Kraft untereinander immer stärker anziehen. Dies wiederum bedeutet, dass man mehr Energie zufügen muss (länger erwärmen muss), bis die Moleküle eine Geschwindigkeit erreichen, die.

VanderWaalsKräfte · Entstehung & Beispiel · [mit Video]
Die Van-der-Waals-Kräfte bezeichnen die Anziehungskräfte zwischen den einzelnen Molekülen. Normalerweise sind die Anziehungskräfte eher schwach und haben eine geringe Reichweite, deshalb wirken sie nur an Stellen, an denen sich Moleküle sehr nah kommen. Wenn ein Molekül also größer ist, hat es eine größere Fläche, mit der es andere.
Elektronegativität
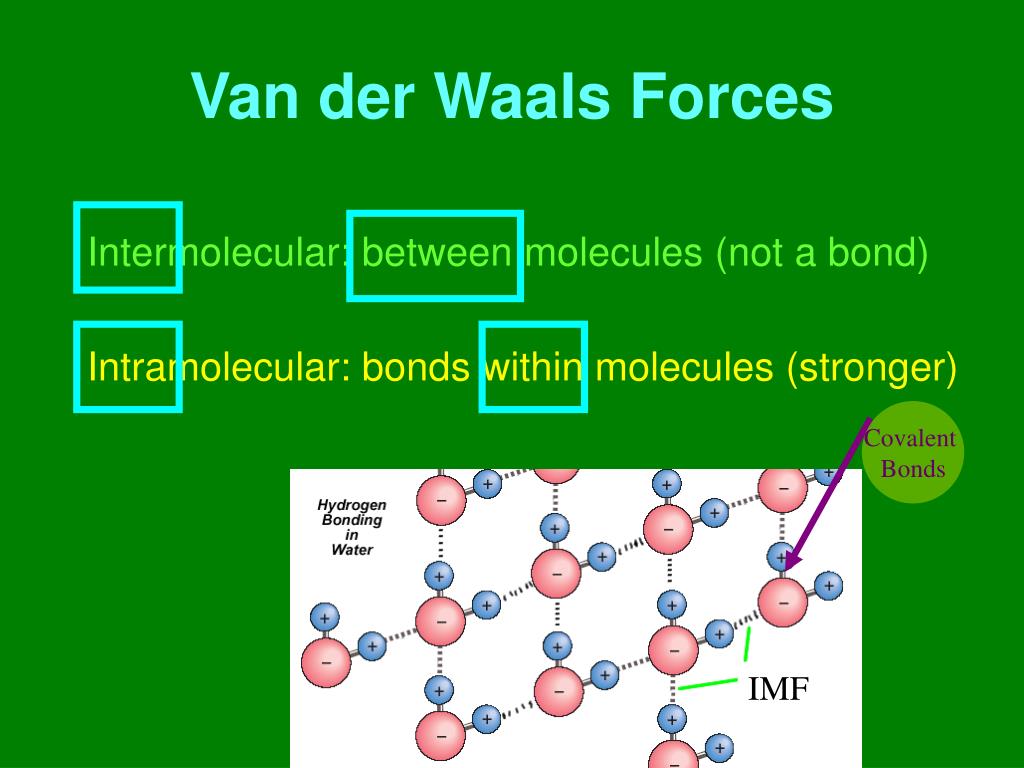
Van-der-Waals-Kräfte Alle Moleküle, auch die unpolaren, üben Anziehungskräfte aufeinander aus. Diese bin-denden Kräfte nennt man Van-der-Waals-Kräfte (nach ihrem Entdecker, dem holländi-schen Physiker van der Waals, 1837-1923). Die Kräfte, mit denen sich die Moleküle gegenseitig anziehen, sind im Allgemeinen schwach.
Van Der Waals Forces Equation
It is more difficult for short, fat molecules (with lots of branching) to lie as close together as long, thin molecules. Example 3.7.1 3.7. 1: Boiling Points of Alkanes. For example, the boiling points of the three isomers of C5H12 C 5 H 12 are: pentane: 309.2 K. 2-methylbutane: 301.0 K. 2,2-dimethylpropane: 282.6 K.
Struktur/Eigenschaften Chemiezauber.de
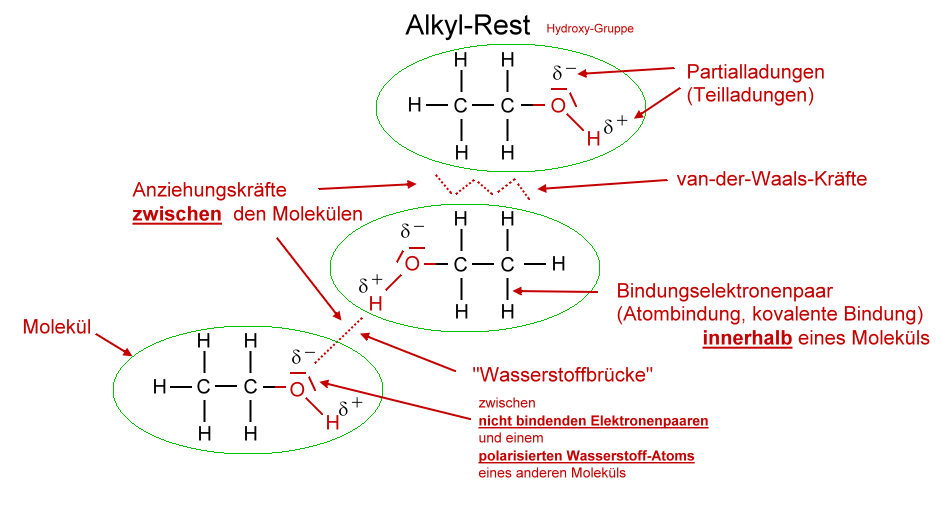
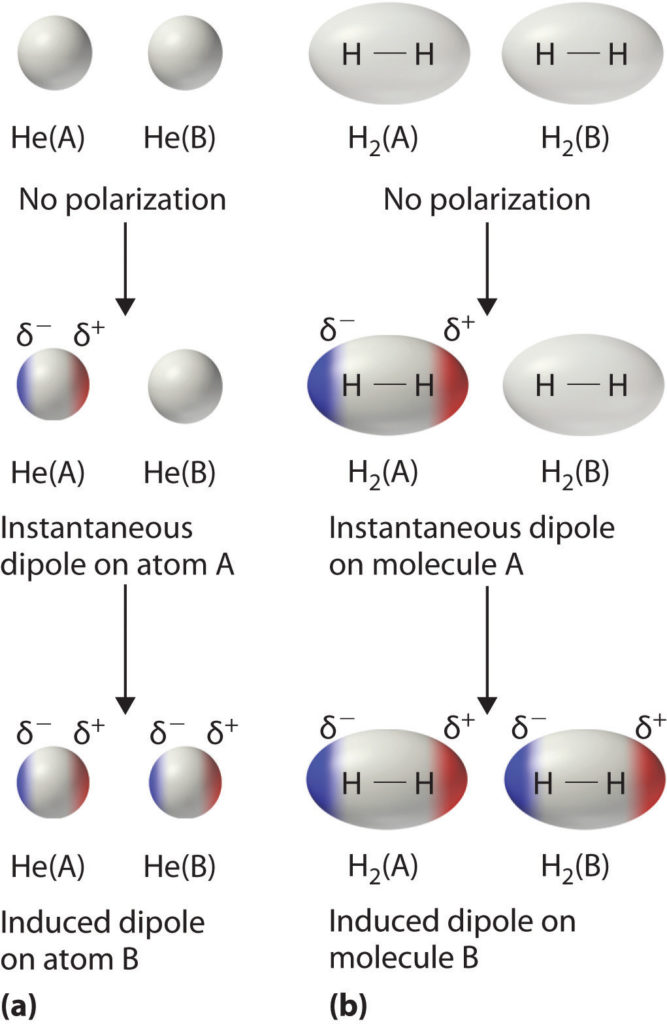
Die "Van-der-Waals-Wechselwirkungen im engeren Sinne" beschreiben die Verschiebung der Elektronen in unpolaren Molekülen. Diese sehr schwachen Wechselwirkungen können nur auf kurzer Distanz zwischen unmittelbar benachbarten Molekülen auftreten. Deshalb werden sie bei hohen Temperaturen durch die thermische Bewegung der Moleküle bereits.

Alkohole • Nomenklatur, Homologe Reihe · [mit Video]
Die Alkane sind das bekannteste Beispiel für die van der Waals Kräfte. Alkane sind Kohlenwasserstoffe mit der allgemeinen Summenformel . Prominente Vertreter sind unter anderem Methan , Ethan oder Butan. Der Vergleich von kurz- und langkettigen Molekülen zeigt eine unterschiedliche Stärke der van der Waals Wechselwirkungen auf.

Van der waals kräfte? Chemie, Alkane, dipol)
In der Chemie unterscheidet man zwei verschiedene Arten von Kräften: Die intermolekularen und die intramolekularen Kräfte. Intermolekulare Kräfte bzw. chemische Bindungen im engeren Sinne herrschen zwischen den verschiedenen Molekülen untereinander. Es gibt die Van-der-Waals-Krafte, die Dipol-Dipol-Wechselwirkungen, die Wasserstoffbrücken.

VanderWaalsKräfte · Definition & Beispiel · [mit Video]
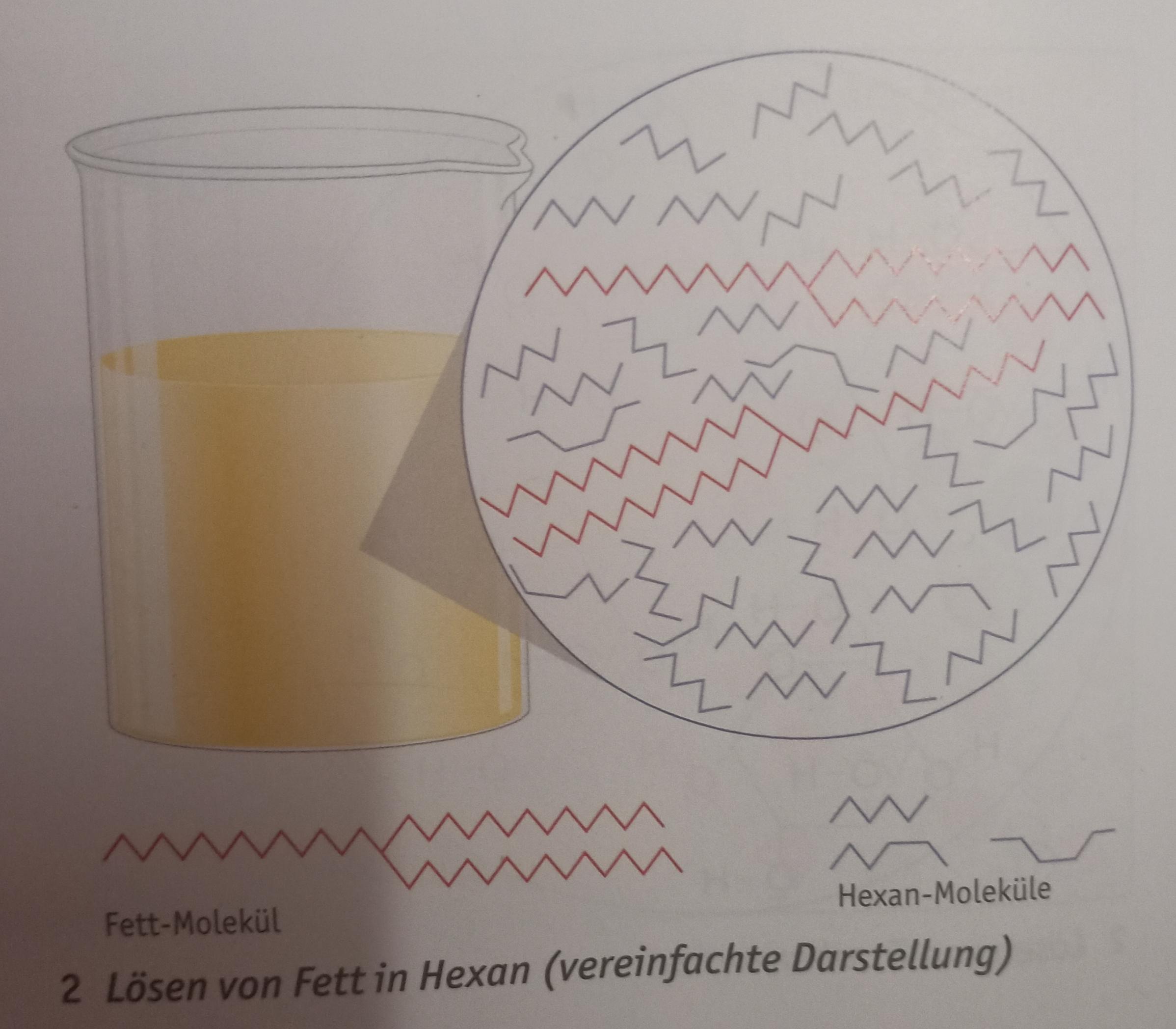
Die Van-der-Waals-Kräfte sind abhängig von der Molekülgröße und Molekülgeometrie. Stark vereinfacht kann man sagen: Die Van-der-Waals-Kräfte nehmen mit der Molekülgröße. Da Alkane unpolar sind, lösen sie sich nicht in polaren Lösungsmitteln wie Wasser. Sie sind hydrophob oder lipophil. Anschaulich gesprochen: Die

four different guitar heads are shown in this diagram
1) where A is the Hamaker coefficient , which is a constant (~10 −19 − 10 −20 J) that depends on the material properties (it can be positive or negative in sign depending on the intervening medium), and z is the center-to-center distance; i.e., the sum of R 1 , R 2 , and r (the distance between the surfaces): z = R 1 + R 2 + r {\displaystyle \ z=R_{1}+R_{2}+r} . The van der Waals force.
Van der Waals (London Dispersion) Forces The Credible Hulk
Lösung: Die van der Waals-Kräfte wirken über die Kontaktflächen zwischen den einzelnen Molekülen. Je größer diese Kontaktfläche, desto stärker diese intermolekularen Kräfte. Das 2,2-Dimethyl-propan ganz rechts hat eine fast kugelförmige Gestalt, daher ist die Kontaktfläche zwischen den Molekülen minimal - wenn sich zwei Kugeln berühren, ist die Kontaktfläche auch minimal.